前言
欧盟当地时间7月17日,欧盟发布《给非欧盟/欧洲经济区国家当局医疗器械和体外诊断医疗器械的情况说明》《Factsheet for authorities in non-EU/EEA states on medical devices and in vitro diagnostic medical devices》。

原文下载链接:
https://health.ec.europa.eu/system/files/2023-07/thirdcountries_factsheet_en_0.pdf
该情况说明标题定义的对象非常明确---for authorities in non-EU/EEA states---给非欧盟/欧洲经济区国家当局,也是因为近两年欧盟新法规推进进展比较缓慢,原持有MDD转换成MDR证书的厂家占比也不大,加之在今年3月20日,欧盟官方 Official Journal 正式发布了 Regulation (EU) 2023/607修改MDR过渡期条款法规,可参见往期推文:
所以该情况说明是给非欧盟/欧洲经济区国家当局的情况说明和梳理,因为又是新法规,又是延期法案,厂家外贸团队在非欧盟/欧洲经济区国家做当地注册时,当地的药监当局可能会面临困惑和混淆,比方说:
某些国家是认可CE证书做当地注册的,比如说澳大利亚,厂家持具已经过期了的MDD证书去注册,那么根据延期法规:
2021年5月26日之后至2023年3月20日之间到期的MDD证书:
在证书没有被公告机构吊销的前提下,需要满足下列条件之一 (注意:是满足两个条件之一,而非两条都要满足),可以延期 :
1)必须已经跟公告机构签署了MDR的认证合同,不能仅仅是提交了认证申请。
2) 欧盟成员国的主管当局根据MDR第59(1)条的规定,对适用的合格评定程序给予豁免,或根据MDR第97(1)条的规定,要求制造商进行适用的合格评定程序。
那么,如果非欧盟/欧洲经济区国家当局在质疑这张已经过期的MDD证书的情况下,可以通过这个官方说明去做解释,以保证当地注册的正常进行。
几个关键时间点
针对MDR,该情况说明书中列明了相应的时间点:
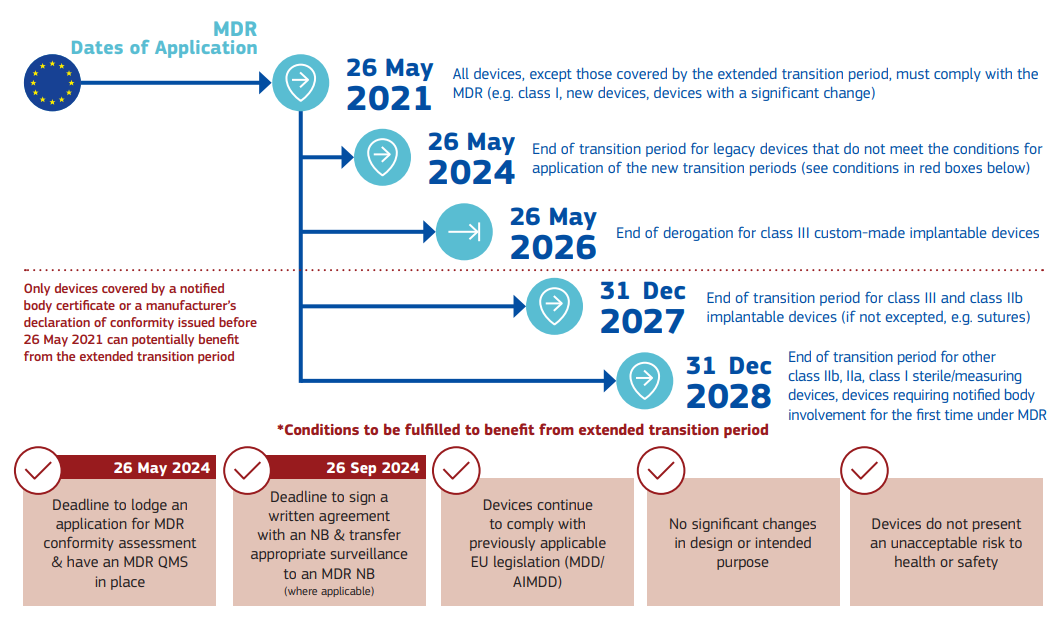
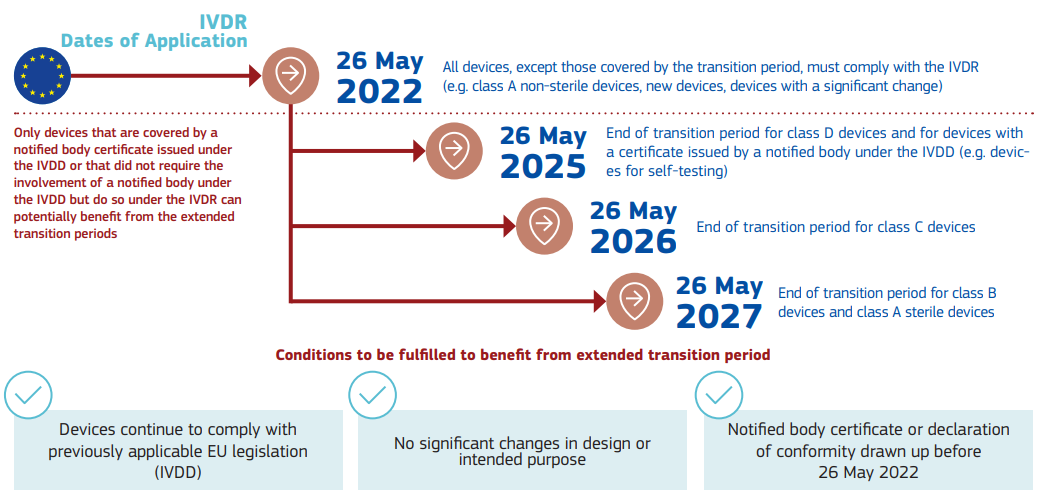
针对IVDR,该情况说明书中列明了相应的时间点:
结语
近两年欧盟医疗器械新法规和延期法案频出,厂家外贸团队在非欧盟/欧洲经济区国家做当地注册时,当地的药监当局可能会面临困惑和混淆。
欧盟此次颁布的情况说明是在厂家外贸过程中,出口国药监对递交的注册资料的重要判断依据,为厂家在非欧盟国家进行医疗器械产品提供了法规上的有利支持。
美德氏医械服务范围
服务 | |
法规合规及产品注册服务
医疗器械法规培训及测试,临床实验服务
服务 | |
MDR 2017/745/EU 法规培训 | |




