线上直播预告
课程时间:
2022年 01月 10日
周一下午 13:30 - 16:00
课程主题:
欧盟MDR法规和MDR技术文档编写要点
扫码进行 01月10日(周一)线上直播培训报名及观看

电脑端可以通过复制网页链接:
https://app7dgkolkf2262.h5.xiaoeknow.com/v2/course/alive/l_61c2ae52e4b0ed68334087dd?app_id=app7dgkolkf2262&alive_mode=0&pro_id=&type=2
进行报名及观看
课程简介
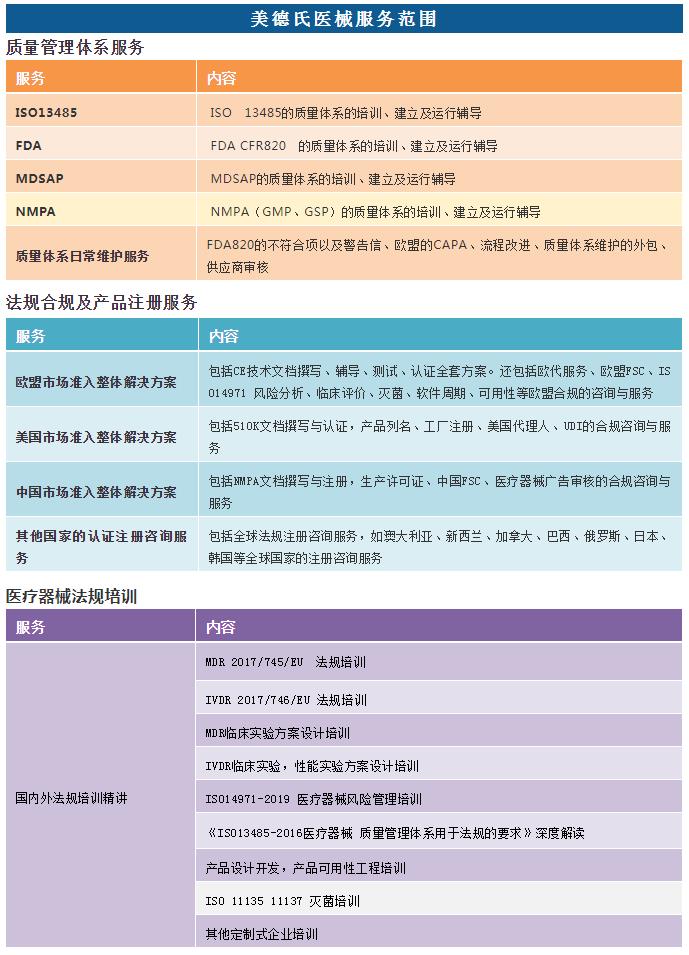
随着MDR法规的正式实施,众多厂家已经开始筹备CE MDR认证,新法规的推出,对于器械生产商提出了更严苛的要求,但是对于MDR法规的一些要点,还有如何编写MDR技术文件,很多厂家还是很难抓住其中的要领。
为帮助企业应对欧盟MDR法规的申请,美德氏医械咨询将于 2022.01.10 日举办【欧盟MDR法规和MDR技术文档编写要点】线上免费培训,特邀各企业届时收看!
课程大纲
1.MDR的颁布背景;
2.MDR过渡期和框架;
3.器械分类和符合性评价路径;
4.MDR 基本安全和性能要求;
5. MDR技术文档要求要点讲解;
6. MDR生物学评估要求;
7. MDR临床评估的要求;
8. MDR上市后监督的要求。
讲师介绍
李王燕 老师
欧美医疗器械法规专家

2016年开始任职于上海康德莱医疗器械集团技术部,现任美德氏医械咨询工程师
ISO13485/MDSAP 医疗质量管理体系专家 ;
5年无源医疗器械研发注册经验,曾编写 MDR 技术文件并顺利通过 TUV 审核;
无源医疗器械产品的 CE 和 FDA 认证注册专家;
精通 ISO14971 风险管理,IEC62366 可用性评估,临床评估,PMS上市后监管,PMCF上市后临床随访,MDR欧盟医疗器械法规;